Стислі теоретичні відомості:
Колоїдні розчини (золі) – це високодисперсні гетерогенні системи, в яких дисперсна фаза представлена не молекулами, а агрегатами, що складаються з великої кількості молекул важкорозчинної речовини. Розміри частинок колоїдних розчинів дорівнюють 10-5 – 10-7 см. Ці розчини термодинамічно нестійкі і мають велику вільну поверхневу енергію.
Золі можуть існувати і при цьому будуть стійкими, якщо виконуватимуться три умови:
- малий розмір часток, що запобігає від седиментації (осідання);
- наявність електричного заряду у частинок, що запобігає від злипання (коагуляції);
- наявність сольватації у частинок, що запобігає від подальшого їх росту.
Частинки, що відповідають цим умовам, називаються міцелами. Тобто міцели – це сольватовані частинки дисперсної фази.
Розглянемо будову міцели. В якості прикладу візьмемо золь броміду срібла, який можна отримати за реакцією:
AgNO3 + KBr = AgBr↓ + KNO3
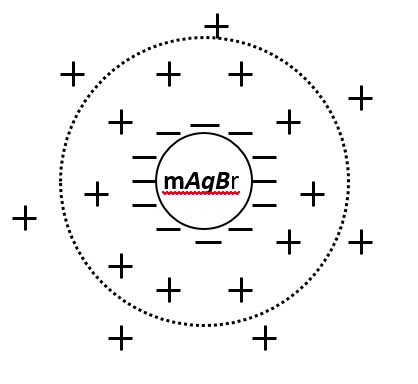
Якщо взяти еквімолярні кількості реагентів, відбуватиметься осадження AgBr, але колоїдний розчин не утворюватиметься. Однак, якщо один з реагентів буде взято у надлишку, наприклад, KBr, утвориться золь, який буде складається з рідкого дисперсійного середовища та твердих частинок дисперсної фази. Мікрокристал кожної такої частинки складається з певної кількості m (сотні або тисяч) молекул AgBr. Саме поверхня мікрокристалу, який називають агрегатом і є тією поверхнею, на якій відбувається утворення подвійного електричного шару (ПЕШ).
За правилом Панета-Фаянса, на поверхні агрегату AgBr з розчину будуть адсорбуватися однойменні або ізоморфні іони, тобто такі активні іони, які мають спорідненість до кристалічної гратки агрегату і здатні її добувати. Оскільки в надлишку взято KBr, частинки броміду срібла будуть адсорбувати певну кількість (n) бромід-іонів Br– (але не іонів К+). При цьому поверхня агрегату набуватиме від’ємного заряду. Іони, адсорбовані агрегатом, називають потенціалвизначаючими. Отже, знак заряду колоїдної частинки визначається знаком заряду потенціалвизначаючих іонів.
В цьому випадку потенціалвизначаючими іонами є іони Br–. Агрегат разом з потенціалвизначальними іонами є частинкою твердої фази, яку називають ядром міцели.
До негативно зарядженої частинки під дією електростатичних сил буде притягуватись n кількість заряджених додатно іонів розчину (К+), які є протиіонами і компенсують заряд ядра. При цьому частина цих іонів, що розташована ближче до частинки утворює адсорбційний шар, а решта частинок, кількістю х, буде знаходитись далі від ядра, в об’ємі розчину, утворюючи дифузійний шар, який зв’язується з ядром доволі слабко. Ядро разом з протиіонами адсорбційного шару називається колоїдною частинкою, або гранулою. Агрегат разом з подвійним шаром іонів називається міцелою. Числа m, n та х можуть змінюватися в широких межах залежно від умов одержання.
Утворення адсорбційного шару перешкоджає подальшому росту ядра, а від’ємний заряд ядра запобігає злипанню частинок (коагуляції).
Структуру міцели ліофобного золю можна показати схематично або записати наступним чином:
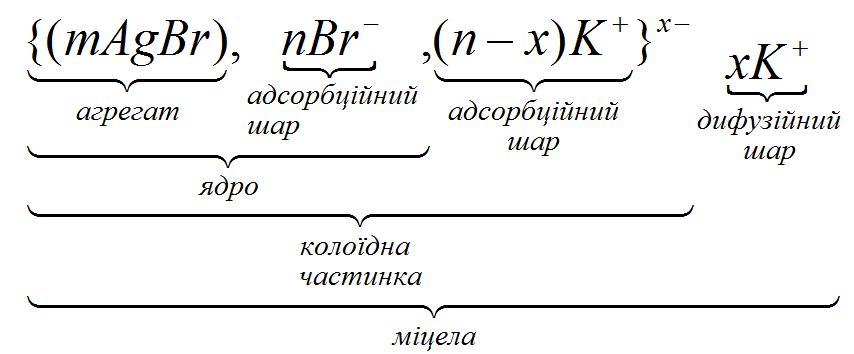
Br– – потенціалвизначаючий іон, К+ – протиіон.
На відміну від частинки, яка має заряд, міцела в цілому – електронейтральна. Якщо при отриманні золю AgBr, в надлишку буде взято AgNO3, утвориться міцела, частинка якої буде заряджена позитивно:
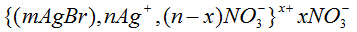
Заряд колоїдної частинки може також з’являтись внаслідок дисоціації поверхневих молекул частинки. Так, наприклад, при отриманні золю кремнієвої кислоти ядро буде складатись з SiO2. Частина поверхневих молекул SiO2 після взаємодії з водою утворює кремнієву кислоту, певна кількість молекул якої дисоціює за схемою: H2SiO3 = HSiO3– + H+
При цьому утворюється золь, міцели якого містять негативно заряджені частинки:
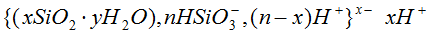
Приклади вирішення типових задач:
Задача 1.Для золю кремнієвої кислоти Na2SiO3(надлишок) + 2HCl = H2SiO3 + 2 NaCl, потенціалвизначальними іонами будуть іони:
1. SiO32–; 2. H+; 3. Na+ ; 4. Cl–.
Пояснення:
Потенціалвизначальними іонами (ПВІ) можуть бути іони, які здатні добудовувати кристалічну гратку агрегату. Агрегат утворений молекулами H2SiO3. Отже , ПВІ можуть бути або іони H+, або іони SiO32–. Na2SiO3 – в надлишку за умовою задачі , тому іони H+ (з HCl) повністю підуть на утворення H2SiO3. Тому, ПВІ – це іони SiO32–. , а іони Na+– протиіони. Отже правильна відповідь – 1.
Задача 2. Золь AgBr отриманий змішуванням 8 мл 0,05н розчину NaBr и 10 мл 0,02н AgNO3. Напишіть формулу міцели золю..
Пояснення:
Для вирішення задачі необхідно визначити, який із реагентів був у розчині в надлишку. Для цього необхідно розрахувати кількість моль-еквівалентів реагуючих речовин за рівнянням:
де Ci – молярна концентрація еквівалентів, моль-екв/л; Vi – об’єм розчину, мл.
Так, для NaBr кількість молей буде складати nNaBr=0,05×8/1000=4×10-4 моль-екв
Для AgNO3 розрахунок наступний nAgNO3=0,02×10/1000=2×10-4
Отже 4×10 -4 > 2×10 -4 , тобто NaBr було взято в надлишку.
Напишемо рівняння реакції:
NaBr(надлишок) + AgNO3 = AgBr↓ + NaNO3.
ПВІ – це іони Br–, які за рахунок надлишку будуть приймати участь у добудові кристалічної гратки агрегату AgBr (згідно з правилом Панета-Фаянса). При цьому протиіонами будуть відповідно іони Na+. Отже формула міцели буде наступна.
{ m[AgBr] nBr–(n–x)Na+}х– xNa+.
Задача 3. Міцела золю Al(OH)3, отриманого при змішуванні розчинів AlCl3 та NH4OH(надлишок), буде мати заряд:
1. позитивний ;
2. електронейтральний;
3. негативний;
4. заряд може бути як негативний, так і позитивний.
Пояснення:
Міцела представляє собою колоїдну частинку, оточену дифузійним шаром. Сумарний заряд протиіонів дифузного шару завжди рівний заряду колоїдної частинки. Тому міцела завжди електронейтральна. Отже правильна відповідь – 2.
Задача 4. Напишіть формулу міцели золю, отриманого за реакцією (NH4)2S + CdCl2 = CdS↓+ 2NH4Cl, якщо в електричному полі частинки золю рухаються до анода.
Пояснення:
Агрегатом міцели, згідно з реакцією, буде малорозчинна сіль CdS. Якщо частинки, за умовою задачі, рухаються до анода, тобто позитивно зарядженого електроду, то заряд колоїдних частинок повинен бути протилежного знаку, а саме негативного. Вочевидь зрозуміло, що серед аніонів розчину (S2- та Cl–), іонами, які б могли адсорбуватись згідно з правилом Панета-Фаянса можуть бути лише S2- . Тоді протиіонами будуть виступати іони NH4+. Таким чином,для отримання золю з негативним зарядом потрібно взяти в надлишку речовину (NH4)2S . При цьому міцела буде мати наступну формулу:
{ m[CdS] nS2– (2n–x)NH4+}2х– 2xNH4+.
Задача 5. Напишіть формули міцел золю, отриманого при змішуванні розчинів 10 мл 0,5н. розчину CaCl2 і 10 мл 0,2н. розчину CuSO4;
Вкажіть агрегат, ядро, колоїдну частинку та визначте знак заряду.
Пояснення:
Напишемо реакцію :CaCl2 + CuSO4 = CaSO4 ↓+ CuCl2
Згідно з умовою задачі видно, що в надлишку буде CaCl2.
Напишемо формулу міцели. Оскільки у іонів кальцію та хлору різна ступінь окиснення , то в формулі міцели потрібно врахувати, що кальцій двовалентний, а іон хлору – одновалентний. Для цього перед іоном хлору потрібно вставляти двійку, при цьому заряд колоїдної частинки буде 2х+ .
{ m[CaSO4] n Ca2+ 2(n–x)Cl–}2 x+ 2xCl–.
Агрегатом буде CaSO4, ядром буде m[CaSO4] n Ca2+ , колоїдною частинкою –
{ m[CaSO4] n Ca2+ 2(n–x)Cl–}2 x+. Заряд колоїдної частинки позитивний.
Задача 6. Який об’єм 0,01н. розчину KBr треба додати до 10 мл 0,25н. розчину AgNO3, щоб колоїдні частинки золю AgBr мали позитивний заряд? Напишіть формулу міцели цього золю.
Пояснення:
Між реагентами протікає реакція
KBr + AgNO3 = AgBr + KNO3.
Щоб отримати золь з позитивно зарядженими частинками, необхідно мати у надлишку розчин AgNO3. Для розрахунку використаємо закон моль-еквівалентів:
С1×V1 = C2×V2.
З цього рівняння визначимо об¢єм KBr, який прореагує з 10 мл 0,25н. розчину AgNO3.
VKBr=C2*V2/C1=0,25*10/0,01=250 мл розчину KBr.
Отже, щоб розчин AgNO3 був у надлишку, необхідно додати до нього об¢єм KBr менший за 250 мл. В цьому випадку отриманий золь буде мати негативно заряджені частинки. Будова золю AgBr відповідатиме наступній формулі
{[m AgBr] .n Ag+.(n-x) NO3–}х+.x NO3–